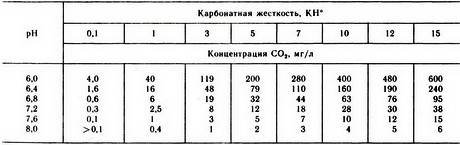
Влияние жесткости воды на кислотность среды рН.
Большинство аквариумистов пользуются водопроводной водой, жесткость которой непостоянна и зависит от материковых пород территории, на которой расположен водоисточник, времени года, количества атмосферных осадков. Солевой состав воды влияет на количество углекислоты, растворенной в воде. В жесткой воде, т. е. содержащей много солей кальция и магния, всегда мало свободной углекислоты, а в мягкой — ее значительно больше. Значение рН в аквариуме подвержено колебаниям, которые связаны с изменением растворенного в воде СО2 и карбонатной жесткостью воды КН. Так, увеличение количества СО2 или снижение КН делает воду более кислой, увеличение КН или снижение СО2 делает ее более щелочной. Значит, все гидробионты своим дыханием способствуют снижению показателя рН.
Особенно заметно это снижение ночью, когда растения не поглощают углекислоту. Днем, во время световой фазы фотосинтеза, активность потребления углекислоты растениями заметно возрастает. Значит, ночью рН в аквариуме перемещается по шкале показателей в кислую сторону, а днем — в щелочную. В жестких водах, содержащих соединения кальция, растения днем выделяют углекислый газ из карбонатных веществ. Происходит этот процесс в виде сложной химической реакции, в ходе которой образуется соль кальция, выпадающая в осадок игольчатыми кристалликами кальцита. Этот осадок покрывает серой пленкой листья тех растений, которые таким путем получают углекислый газ — элодеи, рдесты, кабомбы (не все аквариумные водные растения обладают такой способностью).
КН и pH взаимосвязаны между собой, связь же этих параметров очень проста. Чем выше содержание гидрокарбоната в воде, то есть значение КН, тем выше, а самое главное, стабильнее, значение pH, т.к. он является прекрасным буфером воды. Обратите внимание на слово “стабильнее”. В данном контексте оно означает, что вода с высокой, более 12 градусов карбонатной жесткостью, имеет щелочную реакцию. Вода средней жесткости (6-12 градусов) скорее всего, будет близка к нейтральной реакции (pH ~7,0), а вот вода с карбонатной жесткостью менее 6 градусов КН, по большому счету может быть какой угодно, но, скорее всего, будет кислой. Более низкие значения повышают вероятность обвала кислотности.
Естественным буфером для сдерживания колебаний водородного показателя являются соли, образующие жесткость воды. Чем больше жесткость воды, тем выше ее буферный запас, дающий устойчивость водородного показателя. Буфером может считаться грунт, имеющий в своем составе много известняка — для поддержания высокой жесткости воды. Также буфером может являться кусок дерева, коряга, которая подкисляет воду и понижает pH. Как правило, жёсткая вода обычно имеет щелочной состав (pH>7) и является хорошим буфером. В то же время мягкая вода (pH<7) – несколько кислее и в качестве буфера не годится. Заметим, что буферизация и щелочность тесно связаны, т.к. фактически, щелочность является буфером, замедляющим изменение pH в воде. Как правило, жёсткая вода обычно имеет щелочной состав (pH более 7) и является хорошим буфером. В то же время мягкая вода (pH ниже 7) – несколько кислее и в качестве буфера не годится.
Есть определённая связь между жёсткостью воды и буферизацией. Но при этом жесткость – это преимущественно продукт ионов кальция и магния, а буферизация обеспечивается ионами бикарбоната (гидрокарбонатом) и карбоната (ионами углекислой соли). Как я уже говорил, жёсткая вода обычно является прекрасным буфером, а мягкая вода таковым, как правило, не является. Впрочем, бывают исключения, когда в зависимости от составляющих микроэлементов в воде, жёсткая вода становится плохим буфером, а мягкая, напротив, хорошо буферизует.
Для того чтобы определить качество и способность вашей местной водопроводной воды к буферизации, воспользуйтесь набором тестов для определения pH и временной карбонатной жесткости КН. Затем вычислите общую жесткость gH. Карбонатная или временная жёсткость показывает способность воды к буферизации или, как её ещё называют, способность воды абсорбировать и нейтрализовать лишние молекулы кислоты без изменения уровня pH.
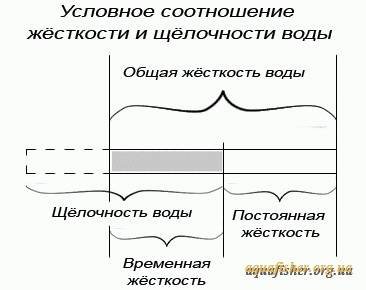
Вообразите, что буфер воды — это большая губка, и чем больше способность воды буферизовать кислоту, тем больше эта губка. Какая буферизация необходима для вашего аквариума? Чем выше карбонатная жёсткость воды КН (то есть, чем больше наша воображаемая губка-буфер), тем более устойчива вода к любым колебаниям уровня рН. Следовательно, уровень КН воды аквариума должен быть достаточно высоким, чтобы предотвратить скачки рН, которые случаются, время от времени по независящим от нас причинам. Если в вашем аквариуме КН менее 4.5°, то надо бы уделять побольше внимания уровню рН (то есть, периодически измерять его) до тех пор, пока не почувствуете уверенность в его устойчивости.
Кстати сказать, буферизация – это, с одной стороны, очень хорошо, а с другой стороны не очень. Плюсом можно считать то, что во время азотного круга буфер заботится о постоянстве рН. Минус буферизации в том, что жесткая вода почти всегда является превосходным буфером, и, если вашим рыбам противопоказана повышенная жёсткость, то снижать её бывает довольно трудно при устоявшемся буфере. Если не учитывать буферную емкость воды, то попытки изменить показатель pH в аквариуме обречены на неудачу.
Буферизация зачастую ассоциируется со щёлочностью, но не следует путать такие понятия как щелочность воды и щелочная среда. Щелочность способствует лучшей буферизации, а щелочная среда – это среда, в которой щелочь несколько преобладает над кислотой. При щелочной среде уровень рН – чуть больше нейтрального, то есть, выше 7. Но не более 8. В то время как щёлочность – это состояние воды, где рН более 8 и созданы прекрасные условия для буферизации (стабилизации) рН.
Буферная емкость относится к способности воды сохранить уровень pH устойчивым при добавлении, как кислоты, так и щелочи в воду. Буферная емкость и pH взаимосвязаны друг с другом; хотя можно было бы предположить, что добавление равных частей кислоты и нейтральной воды приведет к изменению pH в сторону кислой воды, но это случается на практике достаточно редко. Если вода имеет достаточный уровень буферизации, то буферная емкость воды может поглощать и нейтрализовать добавленную кислоту, без значительного изменения уровня pH.
Образно говоря, буфер действует подобно большой губке. Так при добавлении кислоты, губка поглощает кислоту и не дает измениться уровню pH. Емкость губки не безгранична, и как только буферная емкость исчерпывается, pH начинает сильно изменяться при дальнейшем добавлении кислоты.
Какой уровень буферизации необходим для аквариума? В большинстве случаев тестовые наборы, предназначенные для измерения буферизации, фактически измеряют KH воды. Чем выше KH, тем более стойкой будет вода к изменению pH. KH воды в аквариуме должна быть достаточно высока, чтобы предотвратить большие колебания pH, в течение некоторого времени. Если KH воды — ниже 4.5°, Вы должны постоянно контролировать уровень pH в аквариуме, для того что бы быть уверенным, что он не изменяется в опасных пределах. Это особенно важно, если Вы не производите регулярных замен воды.
В частности цикл азота, создает тенденцию для уменьшения уровня pH в течение некоторого времени. Насколько точно понизится уровень pH, зависит от количества произведенных нитратов, также как и от жесткости воды. Если pH снижается больше чем на 0.2 пункта в месяц, необходимо позаботиться о повышении жесткости воды, либо более часто производить ее замену. KH воды непосредственно не влияет на рыб, и обычно нет никакой необходимости точно выдерживать фиксированный уровень жесткости для специфических рыб.
Многие рыбы, беспозвоночные и растения нуждаются в определенном значении pH. Сначала запомним еще одно простое и важное правило: любая рыба гораздо легче адаптируется при переходе из более жесткой и щелочной воды в более мягкую и кислую, чем наоборот. Без всяких проблем можно в течение 20 минут перевести рыбу из воды с dH 20° и рН 8,5 на воду, с показателями dH 6-10° и рН 6,5-7,0. Помните, у рыбы, разведенной и долгое время содержащийся в жесткой и щелочной воде иммунитет гораздо выше, чем у рыб, обитающих в кислой и мягкой воде.
Если в вашем аквариуме общая жесткость лежит в пределах 5-18°dH, то рыбы относительно легко перенесут перепад даже в 5-8°dH. Поэтому в большинстве случаев допустимо фактор жесткости воды не учитывать, и многие аквариумисты-любители так и поступают. (К сожалению, многие не делают и измерений рН и температуры, делать которые абсолютно необходимо!). Причем в реальной практике подщелачивание воды наблюдается крайне редко, а вот снижение рН ниже допустимого уровня получить очень легко.
Недостаточная аэрация воды, избыток в воде соединений азота и свободной органики в виде остатков корма и выделений рыб (если у вас недостаточная фильтрация и не регулярная подмена воды, а также частый перекорм рыбы), злоупотребление подкормкой водных растений углекислым газом и т.д. Все эти факторы, конечно вредны и в воде со средней или высокой жесткостью. Но в мягкой воде они с неизбежностью приводят к закисанию среды ниже допустимых границ и к гибели рыб.
Для пущей строгости добавим, что также известен процесс биогенного подщелачивания воды. Впрочем, наблюдается он не очень часто, а именно в аквариумах с очень большим количеством водных растений, при дефиците СО2. Эффект, опять-таки, угрожающе проявляется в мягкой воде и мало заметен в воде жесткой и средней жесткости. В общем, гидрокарбонат кальция играет в воде роль буфера, препятствующего резким изменениям кислотности. Этот факт является для нас, аквариумистов, очень большим благом.
Аквариумы с низкой карбонатной жёсткостью требуют более частых подмен воды, чтобы контролировать уровень нитратов. Если этого не делать, в аквариуме будет постоянно «скакать» уровень рН. Как и рН, уровень КН возможно регулировать. То есть, уменьшать или повышать буферную способность воды. Как правило, соли, обеспечивающие жесткость воды, одновременно делают ее щелочной. В то же время органические вещества (отходы жизнедеятельности рыб и растений) и растворенная двуокись углерода оказывают на воду окисляющее действие. Нет особого смысла пытаться подкислить жесткую воду, так как содержащиеся в ней минеральные вещества просто вернут значение рН обратно к нейтральному или щелочному, после чего будут требоваться все новые дозы химического средства.
Однако если сначала воду полностью или частично деминерализовать, а предметы декоративного оформления аквариума подобрать так, чтобы они не вызывали увеличения жесткости воды, то окисление можно провести очень просто — для этого нужно использовать торф в качестве фильтрующего средства или экстракт торфа в качестве природного органического подкислителя.
Аналогичным образом рН воды, бедной минеральными веществами, лучше увеличить путем добавления подходящих минеральных солей. Обычно для этого подбирают такие предметы оформления аквариума, в состав которых входит кальций. Если это не приводит к подщелачиванию воды до желаемого уровня, можно использовать гидрокарбонат натрия (пищевую соду) (NaHCO3).
Дозу следует подбирать экспериментально, растворяя гидрокарбонат маленькими порциями в воде и добавляя маточный раствор в аквариум. Для начала можно взять одну чайную ложку (без верха) на 17 литров воды. Если в аквариуме есть рыбы, то, чтобы избежать рН-шока, очень важно изменять рН понемногу (максимум на 0,2-0,3 единицы в день, например, от 7,0 до 7,2 или 7,3). Этому критерию обычно удовлетворяет изменение водородного показателя естественными методами — в частности, путем использования торфа (в фильтрах) или предметов оформления, содержащих кальций.
![]() Как повысить или понизить жесткость аквариумной воды. Снижение жесткости воды.
Как повысить или понизить жесткость аквариумной воды. Снижение жесткости воды.