Равновесие рН – КН – Со2.
Трехсторонняя взаимосвязь между этими величинами обозначает, что, достигнув необходимого значения двух величин, определенное значение третьей устанавливается автоматически. КН и СО2 являются стабилизаторами, т.е. составляющими буферной системы в воде. Если тем или иным способом убрать СО2 из равновесной системы, то она сдвинется влево, и из раствора, содержащего гидрокарбонаты, выпадет в виде осадка практически нерастворимый карбонат кальция. Так происходит, например, при кипячении воды. При этом в ней появляется беловатая муть, состоящая из частичек известняка.
Но раз из воды извлекается вся свободная углекислота, то и рН при этом неумолимо растёт. При таком показателе активной реакции воды в ней почти совсем нет молекул углекислого газа. Как правило, они не могут поднять рН еще выше, так как его дальнейший рост сильно ухудшает функциональное состояние самих растений: фотосинтез, а, следовательно, изъятие СО2 из системы замедляется, и находящийся в воздухе углекислый газ, растворяясь в воде, стабилизирует рН.
Угольная кислота, которая образуется при растворении атмосферного углекислого газа в воде, снижает рН дистиллированной воды до 5,6, а вода с карбонатной жесткостью, к примеру, равной 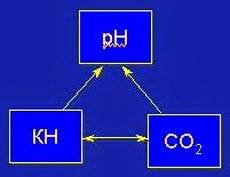 5° KH, находясь в равновесии с атмосферными газами, имеет активную реакцию 8,4. Легко прослеживается такая закономерность: чем выше карбонатная жесткость воды, тем она более щелочная. Вообще-то это правило известно многим, но не все аквариумисты отдают себе отчёт в том, что речь идет именно о карбонатной жесткости. Если карбонатная жесткость воды достаточно велика, то этот процесс может привести к опасному не только для других растений, но и для подавляющего большинства аквариумных рыб росту значения рН аквариумной воды до 10. При повышении количества углекислоты рН уменьшается, а при рН 8,3 в свободном виде она практически не встречается.
5° KH, находясь в равновесии с атмосферными газами, имеет активную реакцию 8,4. Легко прослеживается такая закономерность: чем выше карбонатная жесткость воды, тем она более щелочная. Вообще-то это правило известно многим, но не все аквариумисты отдают себе отчёт в том, что речь идет именно о карбонатной жесткости. Если карбонатная жесткость воды достаточно велика, то этот процесс может привести к опасному не только для других растений, но и для подавляющего большинства аквариумных рыб росту значения рН аквариумной воды до 10. При повышении количества углекислоты рН уменьшается, а при рН 8,3 в свободном виде она практически не встречается.
С ростом карбонатной жесткости концентрация Со2 увеличивается следующим образом: при КН менее 2° до 15 мг/л, от 2 до 10° — 20 мг/л, свыше 10° до 30 мг/л. Повышение температуры уменьшает растворимость углекислого газа с 0,7 мг/л при 10°С до 0,38 мг/л при 30°С. Уровень СО2 в воде может быть определен простым измерением уровня рН. Если уровень рН ниже нейтрального (< 7) значит СО2 в воде слишком много, и вода закисляется. Если уровень рН 7 или выше — значит СО2 мало, и вода защелачивается.
При растворении СО2 в воде, рН падает, что может привести к плачевным результатам. Если вода обладает достаточной жесткостью, то контроль необязателен и, при подаче СО2 в аквариум в разумных пределах — около одного пузырька в секунду, рН будет колебаться в разумных пределах. К концу светового дня растения используют доступный СО2 и, соответственно, рН возрастет. Ночью, когда рыбы и растения выделяют СО2 рН падает. Плавные изменения рН в пределах 1-1,5 градусов в течение суток не страшны и встречаются в природе (опасны резкие скачки в значении рН).
Однако, если в аквариуме рН изменяется сильно или концентрация СО2 к утру поднимается до опасных пределов, то необходимо подумать о контроле поступления СО2 в аквариум. Одним из способов является включение компрессора на ночь. Интенсивная аэрация и перемешивание воды понизят концентрацию СО2 в аквариуме. Если вы используете баллон, то подачу СО2 можно контролировать от таймера или рН контроллера, который управляет клапаном подачи СО2.
При высокой температуре все процессы в растении ускоряются и требуются большего количества питательных веществ, в т.ч. и углекислого газа, что увеличивает потребность в яркости освещения. При интенсивном развитии микроскопических водорослей (вода цветет) происходит выделение большого количества углекислого газа, а это ведет к гибели рыб. Из тёплой воды СО2 быстро улетучивается, и растения начинают голодать. Чем интенсивнее освещение, тем выше потребность растений в углекислом газе. Т.е. при сильном освещении нужно обязательно подавать СО2 в воду аквариума из баллона, чтобы растения не голодали.
У некоторых рыб повышение концентрации углекислоты вызывает рост аппетита, но пища не усваивается нужным образом, и рост потребления корма сопровождается медленным истощением их организма. Избыток свободной углекислоты обусловливает ухудшение питания рыб, вследствие чего снижаются их упитанность и устойчивость к неблагоприятным условиям среды и к возбудителям заразных болезней. Допустимые концентрации свободной углекислоты в воде лежат в пределах 10-40 мг/л.
Как влияют аммоний/аммиак и нитриты/нитраты на показатель рН.
Значение водородного показателя рН в большой степени определяет, какое из этих соединений образуется в преобладающем количестве. Чем больше содержание аммиака, тем больше смещение показателя рН в основную область (более 7,0), а также ядовитость воды. Отравления рыб аммиаком принадлежат к числу самых неприятных сюрпризов, которые только может пережить аквариумист. Токсичность разных элементов азотного цикла сильно различается. Самый ядовитый это аммиак, но к счастью в воде рН около 7 его практически не содержится, при таких значениях рН аммиак переходит в форму существенно менее ядовитого аммония.
Итак, чем выше показатель рН, тем больше опасность отравления. Так, при рН 6,9 в воде содержится только аммоний, при рН 7 = 1% аммиака и 99% аммония, при рН 8 = 4% аммиака, а при рН 9 = 25% аммиака. Поэтому если в аквариуме рН не превышает 7, то не существует острой опасности отравления рыб аммиаком, но при смене большого количества воды (до 1/2 объема) свежей, с рН более 7, из аммония может образоваться значительное количество аммиака, следствием чего станет отравление рыб.
Особое внимание к чистке грунта и частичной подмене воды нужно уделять при рН более 7,5. Концентрацию аммиака и ионов аммония необходимо контролировать в новых, только что  запущенных аквариумах, в аквариумах с высоким уровнем рН (7,8 и более) и при высоких плотностях посадок крупных рыб. В ходе своей жизнедеятельности рыбы выделяют в воду аммиак. Кроме того, в водопроводной воде его концентрация может быть опасно большой, особенно осенью и весной. Аквариум с повышенной температурой также требует большего внимания, например при повышении температуры с 15 до 25°С приводит к увеличению содержания свободного NH3 почти в два раза. При этом надо учесть, что чем выше температура, тем эти значения выше, не смертельная для рыб доза при 20 градусах может стать летальной при 30°С.
запущенных аквариумах, в аквариумах с высоким уровнем рН (7,8 и более) и при высоких плотностях посадок крупных рыб. В ходе своей жизнедеятельности рыбы выделяют в воду аммиак. Кроме того, в водопроводной воде его концентрация может быть опасно большой, особенно осенью и весной. Аквариум с повышенной температурой также требует большего внимания, например при повышении температуры с 15 до 25°С приводит к увеличению содержания свободного NH3 почти в два раза. При этом надо учесть, что чем выше температура, тем эти значения выше, не смертельная для рыб доза при 20 градусах может стать летальной при 30°С.
Хроническое отравление нитратами снижает способность рыб противостоять всем прочим невзгодам. Для отравленных нитратами рыб даже очень незначительного возрастания концентрации аммиака достаточно, чтобы они почувствовали себя плохо. Неплохие прогнозы по уровням нитратов можно сделать, измеряя уровень рН. Когда уровень нитратов увеличивается, уровень рН снижается, вода, в которой много нитратов имеет высокую кислотность, то есть если у вас рН равен 5,0 это говорит о том, что нитратов много. Влияние нитратов на рН осуществляется двумя путями. Нитраты сами по себе остатки азотной кислоты. Когда нитробактерии окисляют органические материалы, они сами потребляют кислород и высвобождают СО2.
Понижение pH и температуры воды приводит к снижению токсичности аммиака, однако при этом эффективность бактерий, перерабатывающих аммиак, падает. Уровень pH играет решающую роль в нитрификации: интенсивнее этот процесс протекает при pH более 7,2 и достигает своего максимума при pH=8,3. При pH менее 7,0 интенсивность нитрификации составляет 50%, при pH=6,5 только 30%. Оптимальные условия для них — нейтральная вода (pH 7,2) и температура около 30°C. Слишком кислая вода может ограничить эффективность биологической фильтрации. При pH ниже 5, их жизнедеятельность практически прекращается.
Определение показателя активной реакции воды – pH.
Очевидно, что комнатный аквариум неизмеримо меньше большинства природных водоёмов. Живой мир, именуемый аквариумом, очень хрупок. И не только потому, что стенки его стеклянные – главная причина в другом: аквариум, даже большой, очень мал для того, чтобы быть стабильной экосистемой. Любое ваше неумелое вмешательство в его жизнь может оказаться фатальным. Вот почему аквариумная экосистема подвержена быстрым изменениям. Для поддержания устойчивого состояния у неё просто не хватает внутренних ресурсов.
Такие важные для здоровья рыбок параметры как кислотность воды (рН), содержание в воде аммиака и нитритов могут существенно измениться не то, что за сутки — за считанные часы! На здоровье рыб это отразится очень плохо. И никакими лекарствами вы им тут не поможете, напротив, только усугубите неблагоприятную ситуацию, еще более нарушив экологическое равновесие в аквариуме. Вмешиваясь в жизнь аквариума, надо знать, какие процессы в нем происходят и к каким результатам они привели, а без диагностики это просто невозможно. Контролируя значения рН, можно своевременно принять меры и не допустить гибели рыб и растений.
Система, которая используется для выражения уровня рН, имеет международное применение, поэтому данные измерений рН, приведенные в литературе по аквариумистике, можно считать универсальными в отличие от данных измерения жесткости. pH — это водородный показатель среды. Если относительно аквариума, то это показатель кислотности (или щёлочности) воды. Значение рН измеряется по шкале от 0 (очень кислая вода) до 14 (очень щелочная вода); значение 7 соответствует нейтральной воде. Если мы измерим уровень pH и получим результат от 1 до 7, то это говорит о том, что среда кислая (значит, в ней преобладают ионы водорода Н+). Если же мы получили pH от 7 до 14 — среда щелочная (значит, в воде преобладают гидроксильные ионы ОН-).
Эта шкала логарифмическая, так что каждое соседнее деление означает десятикратное увеличение или уменьшение уровня рН. Например, если рН = 4, значит, эта вода в 10 раз более кислая, чем вода, у которой рН = 5, и в 100 раз более кислая, чем вода, у которой рН = 6. То есть, обычно уровень pH измеряется в целых и десятых. Например, pH чая – 5,5 (пять целых пять десятых), рН морской воды равен 8,0 (восьми целым), а pH отбеливающей хлорки 12,5 (двенадцать целых пять десятых).
Измерение рН проводят двумя методами: колориметрическим (самый простой) и потенциометрическим. В первом случае изменение цвета индикатора, добавленного в исследуемую воду, сопоставляют со специально откалиброванной цветной шкалой. Это могут быть и бумажные индикаторы — смоченную в воде полоску бумаги сравнивают с соответствующими цветными значениями рН. Второй метод основан на непосредственном измерении специальными приборами, электронными рН-метрами разности электрических потенциалов, регистрируемых электродной системой, погруженной в анализируемую воду. Однако его слабым местом является электрод с диафрагмой, которая забивается. Средства для чистки мало помогают. Обычный срок службы его 1,5-3 года.
Определить показатель рН совсем нетрудно. Промышленность выпускает для аквариумистики специальные индикаторы, с помощью которых установить нужные данные можно без всяких усилий. Эти реактивы продаются в зоомагазинах. Для определения кислотности в аквариумной практике вполне пригодны индикаторные (лакмусовые) бумажки. В Чехословакии выпускают более точные лакмусовые индикаторы рН со шкалой от 1 до 13 с точностью до 0,3 градуса. Окраску индикатора, опущенного в аквариумную воду, нужно сравнить с окраской стандартов в цветной шкале. В соответствии с цветом определяется и показатель рН. Важно упомянуть и о том, что показатель рН для обессоленной водопроводной воды или природной воды с очень малым содержанием минеральных солей определить крайне трудно.
При использовании индикатора (измерение с помощью “листочков рН”) результаты часто оказываются неверными, и опасность ошибки тем больше, чем ниже содержание солей в воде.  Перед проверкой рН надо аэрировать воду 2 часа, чтобы она была насыщена кислородом. Жидкие импортные индикаторы определения рН измеряют одни от 6,0 до 7,6. а другие от 7,2 до 8,8 и позволяют провести до 250 измерений. Измерить рН проще всего с помощью капельных тестов. Определение рН проводится следующим образом: к небольшому объему анализируемой воды, налитому в чистую стеклянную емкость, с прозрачными не окрашенными стенками добавляют несколько капель индикатора. Капают до тех пор, пока цвет раствора не станет достаточно интенсивным для того, чтобы его можно было сравнивать со специальной цветной шкалой.
Перед проверкой рН надо аэрировать воду 2 часа, чтобы она была насыщена кислородом. Жидкие импортные индикаторы определения рН измеряют одни от 6,0 до 7,6. а другие от 7,2 до 8,8 и позволяют провести до 250 измерений. Измерить рН проще всего с помощью капельных тестов. Определение рН проводится следующим образом: к небольшому объему анализируемой воды, налитому в чистую стеклянную емкость, с прозрачными не окрашенными стенками добавляют несколько капель индикатора. Капают до тех пор, пока цвет раствора не станет достаточно интенсивным для того, чтобы его можно было сравнивать со специальной цветной шкалой.
Точно так же, как вы имеете в доме медицинский термометр, вам надо иметь хотя бы минимальный набор аквариумных тестов, если Вы — обладатель аквариума. Среди них особо следует выделить тесты для определения кислотности воды (тест рН), аммиака (тест аммиак-аммоний), нитритов (тест нитрит) и нитратов (тест нитрат). Кроме того, полезно знать общую и временную жесткость воды (тесты dH и КН). Все вместе эти тесты и являются тем самым “градусником”, тем необходимым диагностическим набором, с помощью которого можно выявить неблагополучие в аквариумной экосистеме и оперативно исправить положение.
![]() Буферная емкость и Буферное опрокидывание.
Буферная емкость и Буферное опрокидывание.
Кислотность воды, активная реакция водородных ионов, показатель рН. ![]()





